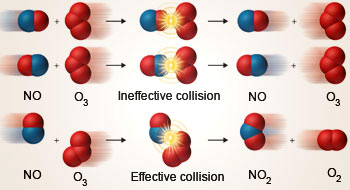
 |
| Hanya tumbukan efektif yang menghasilkan suatu reaksi kimia (Sumber: simply.science) |
Teori Tumbukan (Collision Theory)
- Teori tumbukan (collision theory) adalah salah satu teori yang mengkaji tentang bagaimana suatu reaksi kimia terjadi
- Menurut teori tumbukan suatu reaksi kimia terjadi akibat tumbukan efektif antar partikel pereaksi
- Tumbukan efektif adalah tumbukan antar partikel pereaksi yang arahnya (orientasi) tepat dan disertai energi yang cukup untuk mengatasi energi aktifasi reaksi tersebut
- Energi aktifasi secara sederhana adalah energi minimal yang dibutuhkan untuk suatu reaksi kimia
 |
| Energi aktifasi (Ea) reaksi X → Y atau sebaliknya Y → X (Sumber: wikipedia.org) |
Faktor-faktor Yang Mempengaruhi Laju Reaksi
- Konsentrasi zat
- Luas permukaan bidang sentuh
- Suhu
- Katalisator
Secara umum laju reaksi semakin besar jika konsentrasi pereaksi semakin besar.
Contoh: membersihkan kerak toilet akan lebih cepat jika menggunakan larutan pembersih yang pekat daripada larutan pembersih yang encer
(Penjelasan logika: jika konsentrasi pereaksi semakin besar, maka kemungkinan terjadinya tumbukan efektif akan semakin besar. Bayangkan, jika dalam sebuah ruangan tertutup terdapat orang yeng bergerak bebas, maka semakin banyak orangnya akan semakin besar kemungkinan terjadinya tabrakan antar sesama mereka)
Laju reaksi akan semakin besar jika luas permukaan bidang sentuh pereaksi semakin besar.
Contoh: melarutkan gula jawa yang dihaluskan akan lebih cepat daripada yang tidak dihaluskan.
(Semakin hancur (serbuk) wujud sebuah benda, maka permukaannya akan semakin luas)
(Penjelasan logika: Jika kita membawa sebuah papan tulis yang cukup besar di suatu jalan yang agak ramai, maka kemungkinan terjadinya tabrakan dengan pengguna jalan lain akan semakin besar jika kita membawa papan tulis tersebut dengan posisi tegak melintang daripada membawanya dengan posisi tegak membujur. Hal itu disebabkan posisi tegak melintang memiliki luas permukaan bidang tabrakan yang lebih besar)
Secara umum laju reaksi akan semakin besar jika suhu semakin tinggi.
Contoh: melarutkan gula akan lebih mudah pada air panas dari pada air dingin
(Penjelasan logika: Peningkatan suhu reaksi akan meningkatkan energi kinetik partikel pereaksi. Bayangkan seperti apa tabrakan yang akan terjadi seandainya orang-orang yang ada dalam ruangan pada penjelasan faktor konsentrasi tersebut di atas dalam kondisi energi penuh.)
- Laju reaksi akan semakin cepat dengan bantuan katalisator
- Katalisator adalah zat yang dapat mempercepat laju reaksi. Dalam sebuah reaksi kimia katalisator ikut bereaksi, namun diakhir reaksi tersebut katalisator akan terbentuk kembali
- Peran katalisator adalah menurunkan energi aktifasi, sehingga reaksi terjadi lebih mudah (lihat diagram tingkat energi reaksi di bawah)
- Biokatalisator contohnya adalah enzim
- Inhibitor adalah kebalikan dari katalisator yaitu memperlambat laju reaksi
 |
| Garis merah adalah energi aktifasi (Ea) reaksi yang menjadi lebih rendah dengan keberadaan katalisator (Sumber: wikipedia.org) |
(Semoga bermanfaat - Ahmad Fata)
Referensi
- Utami, Budi dkk, Kimia 2 : Untuk SMA/MA Kelas XI, Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional, 2009